1.จำนวนพันธะโคเวเลนต์ในโมเลกุล CH4 , SiCl4 , NaCl , NH3 เป็นกี่พันธะมีค่าเรียงตามลำดับ คือข้อใด
ก. 4 , 4 , 0 , 3 ข. 6 , 3 , 1 , 0 ค. 4 , 3 , 0 , 3 ง. 5 , 4 , 1 , 0
2. พันธะเดี่ยว หมายถึงอะไร
ก. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่
ข. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่
ค. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่
ง. พันธะที่เกิดจากการใช้์อิเล็กตรอนคู่โดดเดี่ยวร่วมกัน 1 คู่
3. ธาตุในข้อใด เกิดพันธะโคเวเลนต์กับธาตุคลอรีนได้ดีที่สุด
ก. Na ข. Ra ค. C ง. Cs
4. สมบัติทางกายภาพในข้อใด ที่ใช้อธิบายสมบัติทางเคมีของอโลหะ
ก. พลังงานไอออไนเซชันสูง ขนาดอะตอมใหญ่ สัมพรรคภาพอิเล็กตรอนน้อย
ข. พลังงานไอออไนเซชันต่ำ ขนาดอะตอมใหญ่ อิเล็กโทรเนกาติวิตีต่ำ
ค. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก สัมพรรคภาพอิเล็กตรอนน้อย
ง. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก อิเล็กโทรเนกาติวิตีสูง
5. ธาตุ Z มีพลังงานไอออไนเซชันตั้งแต่ลำดับที่หนึ่งถึงลำดับที่ 8 เป็นดังนี้ 1.320, 3.395, 5.307, 7.476, 10.996, 13.333, 71.343, 84.086 ธาตุ Z มีเวเลนซ์อิเล็กตรอนเท่าใด
ก. 1 ข. 4 ค. 6 ง. 7
เฉลยนะจ๊ะ
วันอังคารที่ 23 สิงหาคม พ.ศ. 2559
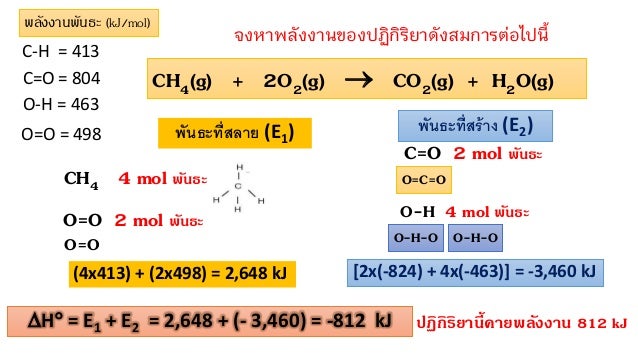
คำนวณพลังงานพันธะ
การคานวณพลังงานของปฏิกิริยา Enthalpy ( DH° )
2. พลังงานพันธะ (Bond energy) • ปริมาณพลังงานที่นอยที่ส ุดที่ใช้เพื่อสลายพันธะระหว่างอะตอมภายในโมเลก ุล ้ (ในสถานะแก๊ส) เพื่อให้เปนอะตอมเดี่ยว โดยคิดจากค่าพลังงานพันธะเฉลี่ย อ่านเพิ่มเติม
ความยาวพันธะและพลังงาน

การสร้างพันธะเคมีเป็นกระบวนการที่จะทำให้อะตอมมีความเสถียรขึ้นกว่าเดิม ความเสถียรมีความสัมพันธ์กับระดับพลังงานของอะตอม อะตอมที่มีพลังงานต่ำจะเสถียรกว่าอะตอมที่มีพลังงานสูง อ่านเพิ่มเติม
การเขียนสูตรและการเรียกชื่อสารโคเวเลนต์

สารประกอบโคเวเลนต์เป็นโมเลกุลของสารที่เกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมาสร้างพันธะโคเวเลนต์ต่อกันด้วยสัดส่วนต่าง ๆ กัน ทำให้เป็นการยากในการเรียกชื่อสาร จึงได้มีการตั้งกฎเกณฑ์ในการเรียกชื่อสารประกอบโคเวเลนต์ขึ้น อ่านเพิ่มเติม
พันธะโคเวเลนต์

จากการศึกษาข้อมูลพบว่า น้ำตาลทราย เอทานอลหรือแก๊สไฮโดรเจน มีจุดเดือดและจุดหลอมเหลวต่ำ เมื่อละลายในน้ำแล้วสารละลายที่ได้ไม่นำไฟฟ้า แสดงว่าสารกลุ่มนี้ละลายน้ำแล้วไม่แตกตัวเป็นไอออน ดังนั้นสารเหล่านี้คงไม่มีไอออนบวกและไอออนลบเป็นองค์ประกอบ อ่านเพิ่มเติม
สมบัติของธาตุตามหมู่และตามคาบ
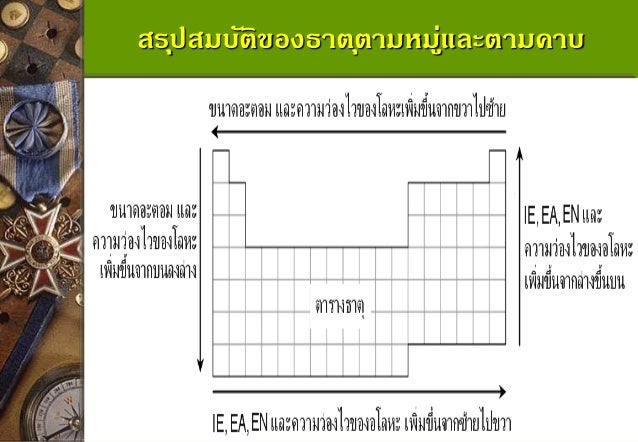
จากการศึกษาการจัดเรียงธาตุในตารางธาตุ ช่วยให้ทราบว่าตารางธาตุในปัจจุบันจัดธาตุเป็นหมู่และเป็นคาบโดยอาศัยสมบัติบางประการที่คล้ายกัน สมบัติของธาตุตามหมู่และตามคาบซึ่งได้แก่ ขนาดอะตอม รัศมีไอออน พลังงาน ไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพรรคภาพอิเล็กตรอน จุดหลอมเหลวและจุดเดือด และเลขออกซิเดชัน อ่านเพิ่มเติม
วิวัฒนาการของการสร้างตารางธาตุ

ภายหลังการค้นพบธาตุต่างๆ และศึกษาสมบัติของธาตุเหล่านี้ นักวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดธาตุเป็นกลุ่มได้หลายลักษณะ ในปี พ.ศ.2360 (ค.ศ. 1817) โยฮันน์ เดอเบอไรเนอร์เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่า ชุดสาม อ่านเพิ่มเติม
สมัครสมาชิก:
ความคิดเห็น (Atom)
